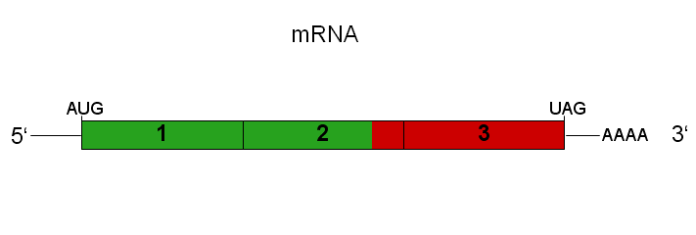
Unlike conventional mRNA вакцыны which encodes only for the target antigens, the self-amplifying mRNAs (saRNAs) encodes for non-structural proteins and promotor as well which makes saRNAs replicons capable of transcribing in vivo in the host cells. Early results indicates that their effectiveness, when given in smaller doses, is at par with that of regular doses of conventional мРНК. Due to low dose requirements, fewer side effects and longer duration of action, saRNA appears as better RNA platform for vaccines (including for v.2.0 of mRNA COVID vaccines) and newer therapeutics. No saRNA-based vaccine or drug is approved for human use yet. However, significant progress in this area has the potential to usher in a renaissance in prevention and treatment of infections and degenerative disorders.
Needless to say, mankind is frail before pandemics like COVID. We all experienced it and were impacted by it in one way or other; millions could not live to see the next morning. Given China too had massive COVID-19 immunisations programme, the latest media reports of spurts of cases and mortality in and around Beijing is concerning. The need of preparedness and relentless pursuit of more effective вакцыны and therapeutics cannot be underemphasised.
The extraordinary situation presented by the COVID-19 pandemic provided an opportunity for the promising РНК technology to come out of age. Clinical trials could be completed at a record pace and мРНК based COVID вакцыны, BNT162b2 (manufactured by Pfizer/BioNTech) and мРНК-1273 (by Moderna) received EUA from the regulators and, in due course, played an important role in providing protection against the pandemic to the people especially in Europe and North America1. These mRNA вакцыны are based on synthetic RNA platforms. This allows for rapid, scalable and cell-free industrial production. But these are not without limitations such as high cost, cold supply chain, diminishing antibody titres, to name a few.
мРНК вакцыны currently in use (sometimes referred to as conventional or 1st generation мРНК вакцыны) are based on encoding the viral antigen in synthetic RNA. A non-viral delivery system transports the transcript to the host cell cytoplasm where the viral antigen is expressed. The expressed antigen then induces immune response and provide active immunity. Because RNA degrades easily and this mRNA in the vaccine cannot self-transcribe, an appreciable amount of synthetic viral RNA transcripts (mRNA) need to be administered in the vaccine for eliciting desired immune response. But what if the synthetic RNA transcript is incorporated also with non-structural proteins and promotor genes, in addition to the desired viral antigen? Such an РНК transcript will have ability to transcribe or self-amplify itself when transported into the host cell though it will be longer and heavier and its transport to the host cells may be more complex.
Unlike conventional (or, non-amplifying) мРНК which has codes only for the targeted viral antigen, the self-amplifying мРНК (saRNA), has ability to transcribe itself when in vivo in the host cells by virtue of presence of required codes for non-structural proteins and a promotor. mRNA vaccine candidates based on self-amplifying mRNAs are referred to as second or next generation мРНК вакцыны. These offer better opportunities in terms of lower dosage requirements, relatively fewer side effects, and longer duration of action/effects (2-5). Both the versions of RNA platform are known to the scientific community for some time. In pandemic response, researchers opted for non-replicating version of mRNA platform for vaccine development in view of its simplicity and exigencies of pandemic situation and to gain experience with non-amplifying version first as prudence warranted. Now, we have two approved mRNA вакцыны against COVID-19, and several vaccine and therapeutics candidates in pipeline such as Вакцына супраць ВІЧ і лячэнне Хвароба Шарко-Мары-Тута.
Кандыдаты на вакцыну саРНК супраць COVID-19
Цікавасць да вакцыны саРНК не вельмі новая. На працягу некалькіх месяцаў пасля пачатку пандэміі, у сярэдзіне 2020 г., Маккей і інш. прадставіла кандыдат на вакцыну на аснове саРНК, які паказаў высокі тытр антыцелаў у сыроватцы мышэй і добрую нейтралізацыю віруса6. The phase-1 clinical trial of VLPCOV–01 (a self-amplifying РНК vaccine candidate) on 92 healthy adults whose results were published on preprint last month concluded that low dose administration of this саРНК based vaccine candidate induced immune response comparable to conventional mRNA vaccine BNT162b2 and recommends its further development as booster vaccine7. In another recently published study conducted as part of the COVAC1 clinical trial to develop booster dose administration strategy, a superior immune response was found in people who had previous COVID-19 and received a novel self-amplifying РНК (saRNA) COVID-19 vaccine plus a UK authorised vaccine8. A pre-clinical trial of novel oral vaccine candidate based on self-amplifying РНК on mouse model elicited high antibody titre9.
Вакцына-кандыдат супраць грыпу saRNA
Грып вакцыны currently in use are based on inactivated viruses or synthetic recombinant (synthetic HA gene combined with a baculovirus)10. A self-amplifying мРНК-based vaccine candidate may induce immunity against multiple viral antigens. Pre-clinical trial of sa-mRNA bicistronic A/H5N1 vaccine candidate against influenza on mice and ferrets elicited potent antibody and T-cell response warranting evaluation on humans in clinical trials11.
Вакцыны супраць COVID-19 атрымалі пільную ўвагу па зразумелых прычынах. Былі праведзены некаторыя даклінічныя работы па ўжыванні РНК-платформаў для іншых інфекцый і неінфекцыйных захворванняў, такіх як рак, хвароба Альцгеймера і спадчынныя захворванні; аднак ніводная вакцына або прэпарат на аснове саРНК пакуль не дазволены для выкарыстання чалавекам. Неабходна правесці дадатковыя даследаванні па выкарыстанні вакцын на аснове саРНК, каб усебакова зразумець іх бяспеку і эфектыўнасць для выкарыстання на людзях.
***
Спасылкі:
- Прасад У., 2020. МРНК-вакцына супраць COVID-19: вяха ў навуцы і змяненне гульні ў медыцыне. Навукова-еўрап. Апублікавана 29 снежня 2020 г. Даступна ў Інтэрнэце па адрасе http://scientificeuropean.co.uk/medicine/covid-19-mrna-vaccine-a-milestone-in-science-and-a-game-changer-in-medicine/
- Блюм, К., ван дэн Берг, Ф. і Арбутнот, П. Самоамплифицированные РНК-вакцыны для інфекцыйных захворванняў. Джын Тэр 28, 117–129 (2021). https://doi.org/10.1038/s41434-020-00204-y
- Пурсейф ММ і інш 2022 г. Самаампліфікацыйныя мРНК-вакцыны: спосаб дзеяння, дызайн, распрацоўка і аптымізацыя. Адкрыццё наркотыкаў сёння. Том 27, выпуск 11, лістапад 2022 г., 103341. DOI: https://doi.org/10.1016/j.drudis.2022.103341
- Блэкні АК і інш 2021. Абноўленая інфармацыя аб распрацоўцы вакцыны з самаампліфікацыйнай мРНК. Вакцыны 2021, 9 (2), 97; https://doi.org/10.3390/vaccines9020097
- Ганна Блэкні; Наступнае пакаленне РНК-вакцын: самаампліфікацыйная РНК. Biochem (Лондан) 13 жніўня 2021 г.; 43 (4): 14–17. зрабіць: https://doi.org/10.1042/bio_2021_142
- Маккей П. Ф., Ху К., Блэкні А. К. і інш. Кандыдат у вакцыну з ліпідных наначасціц РНК з самаампліфікацыяй РНК SARS-CoV-2 выклікае высокі тытр нейтралізуючых антыцелаў у мышэй. Nat Commun 11, 3523 (2020). https://doi.org/10.1038/s41467-020-17409-9
- Akahata W., et al 2022. Бяспека і імунагеннасць самаампліфікацыйнай РНК-вакцыны супраць SARS-CoV-2, якая экспрэсіруе замацаваны RBD: рандомізіраванае, сляпое даследаванне фазы 1. Прэпрынт medRxiv 2022.11.21.22281000; Апублікавана 22 лістапада 2022 г. doi: https://doi.org/10.1101/2022.11.21.22281000
- Эліят Т і інш. (2022) Узмацненне імунных рэакцый пасля гетэралагічнай вакцынацыі вакцынамі супраць COVID-19 з самаампліфікацыйнай РНК і мРНК. Узбуджальнік PLoS 18(10): e1010885. Апублікавана: 4 кастрычніка 2022 г. DOI: https://doi.org/10.1371/journal.ppat.1010885
- Кейха, Р., Хашэмі-Шахры, С. М. і Джэбалі, А. Ацэнка новых пероральных вакцын, заснаваных на самаўзмацняльных наначасціцах ліпідаў РНК (saRNA LNP), LNP Lactobacillus plantarum з трансфекцыяй saRNA і Lactobacillus plantarum з трансфекцыяй saRNA для нейтралізацыі SARS-CoV -2 варыянты альфа і дэльта. Sci Rep 11, 21308 (2021). Апублікавана: 29 кастрычніка 2021 г. https://doi.org/10.1038/s41598-021-00830-5
- CDC 2022. Як вырабляюцца вакцыны супраць грыпу. Даступны ў Інтэрнэце па адрасе https://www.cdc.gov/flu/prevent/how-fluvaccine-made.htm доступ 18 снежня 2022 г.
- Chang C., et al 2022. Біцыстронныя вакцыны супраць грыпу з самаампліфікацыяй мРНК узмацняюць перакрыжаваныя імунныя рэакцыі ў мышэй і прадухіляюць інфекцыю ў тхароў. Метады малекулярнай тэрапіі і клінічная распрацоўка. Том 27, 8 снежня 2022 г., старонкі 195-205. https://doi.org/10.1016/j.omtm.2022.09.013
***